Investigación
La muerte de una joven de 19 años en el Hospital del Niño Poblano evidenció la falla de la farmacovigilancia, aunado a ello, en la Comisión Federal para la Protección contra Riesgos Sanitarios existe incertidumbre en la seguridad de los medicamentos, pues existen alertas sanitarias que advierten sobre el riesgo de los medicamentos falsificados, pero no de la mala calidad de fabricación, lo que refleja una falta especialización y transparencia en farmacovigilancia en México.
Por Alba Martínez / @albamartinez.0 / @seguridadmedic
En México existe una deficiente detección de riesgos en la seguridad de los medicamentos que la población consume. En la última década, en la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), la farmacovigilancia no ha cumplido con la regulación y presenta fallas a la seguridad por la intromisión de empresas farmacéuticas.
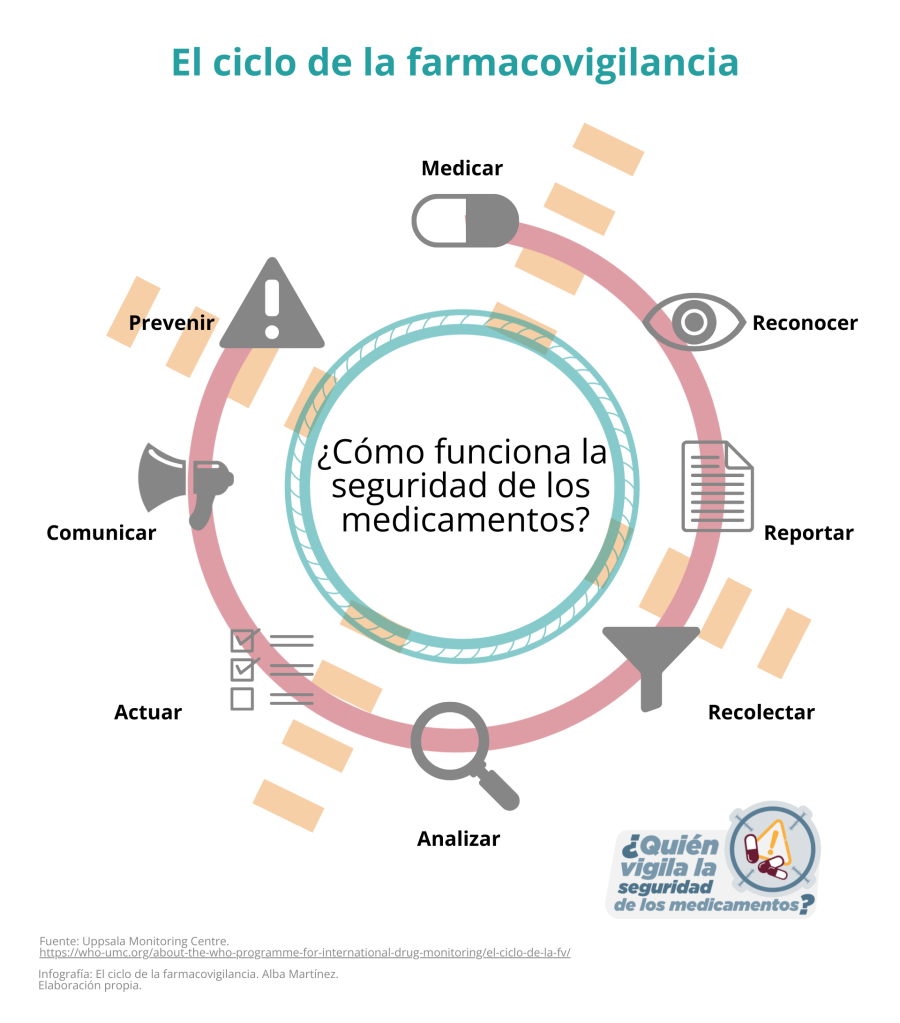
La farmacovigilancia -que son las acciones relacionadas con la detección, evaluación y prevención de las reacciones adversas por el uso de medicamentos, y una herramienta al servicio de la salud pública del país- falló en más de una ocasión y ha sido vulnerada por farmacéuticas que resultan beneficiadas y, mientras el órgano regulador se mantiene omiso, la población consumidora resulta perjudicada.
La determinación de las alertas sanitarias y la cancelación de los fármacos suceden a solicitud de las farmacéuticas y no por acciones de la farmacovigilancia gubernamental.
Peor aún, de julio de 2017 a septiembre de 2019, empresas farmacéuticas vulneraron la plataforma digital NotiReporta, un sistema de cómputo que se utilizó en la Cofepris para captar los avisos de sospecha de reacciones adversas a los medicamentos (RAM) que la población, personal médico y farmacéuticas enviaron a la Cofepris.
La información de todos los avisos, también conocidas como «notificaciones», son la base de la farmacovigilancia nacional ya que de ésta se evalúa el factor riesgo-beneficio de los medicamentos. Sin embargo, durante la operación de NotiReporta, al sistema únicamente debió tener acceso el personal de farmacovigilancia de la Comisión, pero no fue así, usuarios ajenos al órgano regulador pudieron tener acceso al histórico banco de datos y sesgar la información.
Los datos de los registros de RAM que están almacenados en NotiReporta, no se han podido validar porque presenta anomalías que incumplen la NOM-220-SSA1-2016 y causa que la Cofepris no pueda realizar una correcta evaluación de los riesgos en el consumo de los medicamentos disponibles en el mercado.
Las fallas: inexistencia o insuficiencia de datos, sub-notificación, mal registro, redundancia, incoherencias, falta de motivación de los notificadores, conflictos de intereses entre prescriptores, dispensadores y de la propia industria farmacéutica.
Tres casos: Rosa Itzela era una joven de 19 años que era atendida en el Hospital del Niño Poblano (HNP) por cáncer en la sangre, leucemia linfoblástica aguda, había sido diagnosticada en septiembre de 2017. Casi un año y medio después, el 13 de febrero de 2019, ella y otros dos menores de edad, Emir e Iván, de 11 y 16 años, presentaron reacciones adversas neurológicas graves al medicamento durante la quimioterapia con Metotrexato. Dos días después, el 15 de febrero, cerca de las 15:00 horas, Rosa Itzela murió.
Después del fallecimiento de la joven, el secretario federal de Salud, Jorge Alcocer Varela, compareció en la Cámara de Diputados en octubre de 2021 y, ante los cuestionamientos, refirió que las causas de las reacciones adversas se debieron a la mala calidad de un lote de Metotrexato. En consonancia, en una conferencia de prensa, su homólogo en Puebla, José Antonio Martínez García, corroboró la versión, pero ambos no brindaron información precisa porque, la que pudo dar luz al asunto, cayó en un profundo «vacío» en los procesos de farmacovigilancia y en malas prácticas de fabricación.
El día de los hechos, Rosario de la Rosa Nava, responsable de las funciones de farmacovigilancia en el HNP, envió a la Cofepris y al laboratorio fabricante, Laboratorios Pisa S.A. de C.V., los tres avisos alertando de las reacciones adversas al medicamento. Los documentos permanecen velados e impresentables en el Centro Nacional de Farmacovigilancia (CNFV) y en la Comisión de Evidencia y Manejo de Riesgos (CEMAR). Ambas instancias son las responsables de recibir y analizar la información sobre las sospechas de reacciones adversas a los medicamentos y de las vacunas.
Además, la Cofepris niega la existencia de correos electrónicos y de otros documentos relativos al evento en Puebla, con lo que incumple la resolución a un recurso de revisión por la información no proporcionada.
Sin embargo, parte de la documentación se obtuvo de la Secretaría de Salud de Puebla, mediante recursos de revisión y, para cotejar, fue consultada de manera directa en el HNP. Los registros son: 88840, 88813 y 88479.
Conforme al proceso de farmacovigilancia de Cofepris, estas presentan irregularidades: faltan a la exhaustividad, al grado de información e integridad de los datos. Por ejemplo, de los lotes de Metotrexato reportados como sospechosos, L18T055 y L18T056, Pisa Farmacéutica desconoce que haya fabricado el primero, según consta en el oficio COS/DEPE/138/2019, obtenido vía transparencia de la Cofepris.

Y, del lote L18T056, a la autoridad sanitaria se le solicitaron, también por transparencia, copias de todas las notificaciones de reacciones adversas al medicamento Metotrexato presentadas del 1 al 20 de febrero de 2019 en el hospital poblano y la respuesta fue de inexistencia de esa información, «en virtud de que no obra en los archivos de las bases de datos del Centro Nacional de Farmacovigilancia».
La farmacovigilancia no pudo responder como dicta la norma regulatoria, la NOM-220-SSA1-2016. En el CNFV no existe informe que explique o evidencie acciones realizadas. No las hubo. De los dos lotes del medicamento reportados como sospechosos, tampoco existió identificación, validación de la causalidad, análisis, evaluación de la severidad ni de la gravedad, que son las señales de seguridad de los medicamentos.
Es más, los datos de los tres avisos tampoco pueden ser consultados en NotiReporta, por la falta de información en la base de datos del sistema que se pudo constatar en la consulta directa realizada en la Cofepris. No aparecen.
En 2020, Hugo López-Gatell, subsecretario de Prevención y Promoción de la Salud, expuso que la empresa fabricante del Metotrexato, Laboratorios Pisa, causó el desabasto de oncológicos en el país. Del asunto, la Cofepris informa que, entre 2019 y 2021, a la farmacéutica se le abrieron 18 procedimientos por irregularidades en los procesos de fabricación, seis concluyeron y doce continúan abiertos, también le fueron aplicadas once sanciones de multa por malas prácticas de fabricación de los medicamentos.
Tres de los procedimientos se abrieron a partir de los eventos sucedidos en Puebla, así consta en el expediente consultado vía directa por transparencia en las instalaciones de la Cofepris. Son siete tomos que incluyen las verificaciones, sanciones e información considerada confidencial a solicitud de Laboratorios Pisa, y la que ha sido reservada por cinco años “por considerarse asunto de seguridad nacional”, cita la respuesta vía transparencia y así también lo informa el personal de la Comisión de Operación Sanitaria. Actualmente, los procedimientos siguen en plazo de corrección de anomalías. Ningún reporte de farmacovigilancia está incluido.
Peor aún, la plataforma digital para captación de los avisos fue vulnerado en ese periodo y, en el sistema NotiReporta, que debió contener el registro de las notificaciones enviadas desde el Hospital del Niño Poblano, no es posible consultarlos.
Por ejemplo, del medicamento oncológico utilizado para las quimioterapias infantiles, Metotrexato, se tienen 1,362 notificaciones de 2010 a julio de 2022; de estas, son 641 captadas por Access y e-Reporting y otras 721 en VigiFlow. Pero, del periodo de operación de NotiReporta, de julio de 2017 a septiembre de 2019, se desconoce la información porque “no se han validado los datos”, asegura personal de farmacovigilancia consultado directamente en la Cofepris.
Como este, existen más casos y asuntos de seguridad de medicamentos y vigilancia de manufactura de las farmacéuticas de los que también se desconoce si los procedimientos de farmacovigilancia han sido eficaces o de los que hayan derivado en acciones de alerta o retiro del mercado.
«La seguridad es el riesgo aceptable en términos del análisis riesgo-beneficio»
─ Rogelio Fernández Argüelles
En esta investigación, especialistas en la materia advierten la relevancia de los procedimientos de farmacovigilancia y de la necesidad de trazabilidad de los productos para evitar cualquier problema de seguridad relacionado con el uso de los medicamentos y vacunas. Señalan la insuficiencia de transparencia, la falta de profesionalización y soluciones concretas que garanticen la seguridad de los fármacos que la población consume.

¿Quién vulneró la farmacovigilancia?
Propharma Research Organization, S.A de C.V es la empresa proveedora que prestó los servicios del sistema NotiReporta, plataforma digital para el registro de las notificaciones de RAM. Mientras estuvo en operación, este sistema no funcionó de manera correcta ni conforme a la regulación entonces vigente.
Sin embargo, la Dirección Ejecutiva de Farmacopea y Farmacovigilancia (DEFFV) de la Cofepris ─responsable de la implementación y operación de NotiReporta─ informa que desconoce el número de usuarios con acceso al sistema, tampoco la identidad. No puede explicar el funcionamiento ni el formato de la información captada y emitida. No explica las incidencias, la síntesis de análisis realizados, los objetivos, las canalizaciones, los programas alcanzados ni el monto económico invertido en su adquisición.
Por esa razón se solicitó información a otras instancias de la Cofepris con el propósito de conocer si existió un contrato, acuerdo, convenio o algún otro tipo de instrumento legal o administrativo por el que el sistema NotiReporta se instaló y operó en la DEFFV. Pero, la Coordinación Jurídica de la Cofepris informó que no reconoce ningún acto administrativo que le justifique. A su vez, la Dirección Ejecutiva de Recursos Financieros informó que no existe monto económico que haya sido erogado para ese fin.
Por otra parte, Propharma Research Organization, S.A, de C.V, la proveedora, habría vendido la información recabada en el sistema a farmacéuticas privadas, así lo señaló en septiembre de 2019 el ex titular de la Cofepris, Alonso Novelo Baeza, en su comparecencia en el Senado de la República. Él refirió un fraude al gobierno.
De si existió o no evaluación de calidad de los medicamentos, Novelo Baeza remató:
“no podía haberlos, no había farmacovigilancia, para empezar Desapareció la farmacovigilancia en México. Salieron a la venta las notificaciones hechas a NotiReporta y el primer laboratorio, no quiero decir el único, porque no tengo la certeza, pero el primer laboratorio que lo adquirió fue Pisa y Pisa tenía información privilegiada. Y todos los eventos de alerta sobre farmacovigilancia, reacciones adversas, etcétera, se mantenían ocultas. Si estoy equivocado, quiero saber si hubo alertas públicas sobre medicamentos en los tres, cuatro años pasados”.
Personal adscrito al CNFV, consultado de manera directa en Cofepris, así también lo reconoce y aseguran que el sistema tuvo muchas deficiencias y la empresa proveedora entregó un banco de datos en el que no se puede confiar.
Según información obtenida vía transparencia, el banco de datos que contiene todas las notificaciones registradas en el CNFV es de 533 mil 135 notificaciones captadas en tres sistemas, de 2001 a 2021: Access, NotiReporta y VigiFlow. La información en NotiReporta, cerca de 100 mil notificaciones –el 18.7 por ciento del total de los registros– está contenida de manera sesgada y no puede ser consultada.
Cabe señalar que, durante el Primer Congreso de Farmacovigilancia Hospitalaria realizado en octubre de 2022 en la Ciudad de México, los ponentes del CNFV, Yoav Yael Hernández y Gandi Rayón Ramírez, expusieron la relevancia de las notificaciones y la calidad de información de estas para realizar los análisis y evaluaciones que resultan vitales para la seguridad de los pacientes. Y mencionaron que hubo un incremento del 93 por ciento de notificaciones durante los años de pandemia: 60 mil era el promedio anual hasta 2019 e incrementó a un máximo histórico de 86 mil en 2021. Estas incluyen cerca de 34 mil notificaciones atribuibles a la vacunación contra la Covid-19.

La farmacovigilancia regulada por el estado ha tenido modificaciones a su normatividad y estas responden al cumplimiento de actividades cruciales como la generación de señales de alerta y a la homologación con los lineamientos internacionales sobre las manifestaciones clínicas ocasionadas por el uso de medicamentos y vacunas. Las últimas modificaciones a la NOM-220-SSA1-2016 fueron publicadas en el Diario Oficial de la Federación (DOF) el 30 de septiembre de 2020.

¿Por qué es importante la farmacovigilancia?
A enero de 2023, son cerca de 1,790 los medicamentos que componen el mercado nacional y se clasifican desde los que pueden adquirirse sin prescripción médica hasta los de alto riesgo, incluyendo oncológicos como el Metotrexato. Diecisiete farmacéuticas mexicanas concentran la producción de los genéricos.
Por ello debe existir una rigurosa regulación y se deben tomar acciones que garanticen la seguridad de los medicamentos que consume la población. Esta tarea es materia de la Cofepris que cuenta con el CNFV como herramienta de vigilancia de los medicamentos en consumo, su calidad, seguridad y eficacia.
En el ámbito internacional, en 1997 México se incorporó formalmente a las actividades al Programa Internacional de Monitoreo de Medicamentos de la Organización Mundial de la Salud (OMS) conforme a la Ley General de Salud (LGS), integrándose al Programa Internacional de Farmacovigilancia en 1998 y es miembro oficial a partir de 1999.
Entonces comenzó la comunicación sobre las notificaciones de reacciones adversas a medicamentos al Centro Internacional de Farmacovigilancia de Uppsala, en Suecia. Pero el sistema NotiReporta resultó incompatible con los estándares internacionales e imposibilitó el envío de información.
En 2019 la organización Mundial y Panamericana de la Salud (OMS/OPS, por sus siglas en inglés), destacaron la decisión de que la Cofepris recuperara y asumiera la responsabilidad de la farmacovigilancia, apegada a las normas internacionales dispuestas y, a partir de septiembre del mismo año, se comenzó a operar la plataforma VigiFlow, que reemplazó al sistema NotiReporta.
Y fue en diciembre de 2021 que los organismos internacionales participaron, con la Cofepris, en la mesa redonda: Fortalecimiento de la Farmacovigilancia en México, enfocada en los “pasos para la implementación de la nueva estrategia de farmacovigilancia”, incluyen capacitaciones y el “reforzamiento” de las capacidades de reporte de Reacciones Adversas a los Medicamentos y otros.
José Gotés Palazuelos, especialista en medicina interna, endocrinología, farmacología clínica y farmacovigilancia en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (INCMNSZ), dice que después de la emisión de las notificaciones, el flujo de información debe conducir a la retroalimentación y que de esta depende que se generen señales de seguridad de los medicamentos:
“a lo largo de esa información hay recursos, estudios, investigaciones que se van generando de esa información que se obtienen con todas esas bases de datos y que van desarrollando nueva información de seguridad”.
Existen diversidad de circunstancias que pueden ser evaluadas como problemas de seguridad de un fármaco, desde los relacionados a la producción de los medicamentos, como contaminación en las líneas de producción, la no validación de los procesos del producto, las deficiencias y anomalías en las revisiones documentales y hasta las respuestas al uso de los medicamentos en consumidores.
“Por eso, este estudio de los aspectos de seguridad con medicamentos es una ciencia compleja, porque involucra la comprensión y la evaluación de cada uno de esos aspectos relacionados a la seguridad del medicamento”.
Las compañías farmacéuticas que tienen registros sanitarios de medicamentos están obligadas a proveer informes de seguridad de manera periódica con respecto a cada uno de sus fármacos. A ese respecto, el especialista refiere que a partir de señales de seguridad en farmacovigilancia “es frecuente que haya suspensiones de registro o retiro de medicamentos del mercado”.
En contraste, Gilberto Castañeda-Hernández, investigador titular del Departamento de Farmacología del Centro de investigación y de Estudios Avanzados del Instituto Politécnico Nacional (Cinvestav-IPN), apunta que la farmacovigilancia de la industria farmacéutica en México simplemente comercializa y no brinda planes de manejo de riesgos, los que tendrían que ser evaluados por la Cofepris:
“no tienen absolutamente ninguna vigilancia de qué está sucediendo con sus productos. Simplemente están ganando dinero, fundamentalmente con ventas al gobierno. Y si causa daño a nadie le importa, porque ya se llenaron los bolsillos”.
Para fines de esta investigación se ha solicitado en cuatro ocasiones vía transparencia información sobre los registros sanitarios de medicamentos cancelados y conocer los motivos. Por ello se interpusieron tres recursos de revisión que se resolvieron en favor del consultante, pero, desde marzo de 2021, la Cofepris evade proporcionar la información precisa.
A la fecha de cierre de esta publicación, la Cofepris señala que del periodo de 2001 a 2014 la información sobre los medicamentos cancelados es inexistente. Y que de 2015 a 2022 se han cancelado 550 medicamentos, pero omite aclarar las razones. De 2021 y 2022, expone que los 109 medicamentos han sido cancelados “a solicitud del titular”, las farmacéuticas.

¿Medicamentos sin vigilancia eficaz?
Ernestina Hernández García, investigadora en ciencias médicas del Instituto Nacional de Pediatría (INP) refiere las estrictas especificaciones que los medicamentos deben cumplir para garantizar su seguridad. “Los informes y reportes de los productos deben contener la totalidad de notificaciones de reacciones adversas para tener los análisis de causalidad de los casos que se pueden presentar en la población consumidora, ya que pueden generar señales en relación con la seguridad de los medicamentos utilizados, por ejemplo, en la población infantil”.
Dentro de la normatividad, las reacciones adversas se pueden clasificar en leves, moderadas o severas o en graves y no graves. Cuando se consideran graves es cuando incapacitan al paciente, ponen en riesgo su vida o causan la muerte. “El laboratorio tiene la obligación de hacer ese análisis de causalidad y si fueron graves, no graves, moderadas, severas si son probables, posibles, dudosas o definidas. Entonces, le tiene que dar ese reporte a la Secretaría de Salud”.
Sobre las acciones de seguridad y calidad de los medicamentos derivadas de investigaciones de la autoridad sanitaria, la investigadora dice que:
“puede ser que se haga un ordenamiento para el retiro de tan solo un lote para hacer investigación, pero, si se encuentra que no se está cumpliendo con las especificaciones se procede al cierre de las áreas donde se fabrican los medicamentos”.
En septiembre de 2019, después del evento sucedido en Puebla que derivó en el cierre de líneas de producción de Laboratorios Pisa, un documento interno del sector salud, reveló que un lote de Metotrexato, L19M042, Tratoben por su denominación distintiva, también fabricado por Pisa, incumplió pruebas de esterilidad del producto, pues éste desarrolló un microorganismo llamado Bacillus simplex, “lo que representa un riesgo para la salud de los pacientes a los que se les administre”, cita el oficio COS/DEPE/682/2019.
Sin embargo, al igual que los lotes de medicamentos involucrados en las reacciones adversas en el HNP, no hubo razón aparente para que las autoridades consideraran necesario emitir alertas sanitarias hacia la población en ambos casos. Todo quedó en el mismo oficio: 
Con respecto a la regulación y acciones de farmacovigilancia de la Cofepris, Gilberto Castañeda-Hernández, apunta, “esta farmacovigilancia está muy dirigida a los problemas específicos de la industria, es decir, a sus productos”.
Por ejemplo, el medicamento Femulan se usaba en pacientes con trasplante renal, pero, por la falta de seguridad y calidad del medicamento, éste salió del mercado. “Medicamento de uso delicado que pudo haber causado falla terapéutica con consecuencias graves”, expresa Castañeda-Hernández, quien en 2009 estuvo a cargo del comité evaluador del fármaco.
El investigador advierte que compañías mexicanas han accionado de esta manera con el propósito de ganar licitaciones sin comprobar la bioequivalencia como corresponde:
“Hemos tenido productos de los llamados genéricos que en realidad no son genéricos, sino productos que entran en el mercado por cuestiones fundamentalmente de corrupción, sobre todo en el pasado. Entran estos productos sin suficientes estudios y empiezan a causar daño. Por ello el Femulan tuvo que ser retirado del mercado.”
En 2009, el caso de Femulan fue a dar hasta los tribunales cuando Landsteiner Scientific de México demandó al grupo de científicos encabezado por el investigador. Les exigía retractarse del artículo en la revista científica y una compensación económica por la publicación en Transplantation Proceedings que exponía la mala calidad del medicamento.
La farmacéutica nunca pudo demostrar que su medicamento entró al mercado con la normatividad vigente. No contaba con los estudios necesarios para ser aprobado por la Cofepris, pero además intentó realizar estudios manipulados para defender su producto.
El medicamento Sirolimus, para tratar la insuficiencia renal, actualmente está siendo fabricado en México por la farmacéutica Pfizer, S.A. de C.V. Antes fue así, en abril de 2007, la compañía Landsteiner Scientific, S.A. de C.V. comenzó la producción del medicamento genérico, pero, en 2010, fue demandada penalmente por falsificarlo.
Otras irregularidades sucedieron con los medicamentos, Omeprazol, Zotralox, Nimesulida y Reumofan Plus, éstas derivaron en el retiro del mercado por la falta de calidad cuando se demostró daños a la salud en consumidores de los fármacos.
Lo anterior sucedió en 2012, cuando la Cofepris aseguró un promedio de 3 mil 500 productos principalmente en Tamaulipas a consecuencia de las alertas sanitarias emitidas por la Federación y dado que éstas representaban un problema serio para el consumidor, así lo advertían las nueve alertas sanitarias, de las cuales cinco correspondieron al retiro de los medicamentos. Estos fármacos fueron elaborados por los laboratorios Reuffer, Farmaden, el Laboratorio Médico Químico Biológico y Landsteiner Scientific.
Otro ejemplo es el caso de los medicamentos que contenían en su fórmula activa la Ranitidina y la Metformina, de éstos difícilmente se encuentran datos históricos por daño a la población como tal, o que se debían retirar. No fueron suspendidos por la Cofepris y únicamente se emitió un “aviso” y no una “alerta sanitaria” por la aparición de nitrosaminas en las formulaciones, elementos hoy reconocidos como cancerígenos.
En México y en lo que respecta a los riesgos generados por las nitrosaminas, la Ranitidina y Metformina, se produjo el aviso por parte de la Cofepris para suspender su uso. En enero de 2020, se emitió una actualización de este: la suspensión de la producción a las farmacéuticas, agotarse las existencias en los servicios de salud, distribuidores y puntos de venta de conformidad a los contratos comerciales existente entre las partes, establecer las acciones y disposiciones correspondientes. Pero para la población, el aviso fue otro: “evitar la compra de medicamentos que contengan Ranitidina”.
Mientras que, para las agencias internacionales como la Administración de Medicamentos y Alimentos de Estados Unidos y la Agencia Europea de Medicamentos (FDA y EMA, por sus siglas en inglés) el aviso fue distinto, “sacar el medicamento del mercado”.
Por su parte, Rogelio Fernández Argüelles, presidente del Drug Utilization Research Group, Latin America (DURG-LA, por sus siglas en inglés) y docente en la Universidad Autónoma de Nayarit (UAN), califica este hecho como:
“un caso muy raro. No me explico por qué salió esa alerta por las nitrosaminas si están en nivel de advertencia dos, como cancerígeno, pero ni siquiera en uno, en dos, un grado inferior de riesgo y se ha dado esta alerta y yo todavía no entiendo por qué”.
El especialista también considera que es imposible responder sobre la seguridad y calidad de los medicamentos, porque, además, el sistema de farmacovigilancia es tardado e ineficiente. Refiere que la farmacovigilancia de México está sustentada en más de un 70 por ciento en los reportes de la industria, “tienen un carácter pasivo y sesgado porque hay poca cultura de la notificación en el médico, en el paciente y en el prescriptor”.
Apunta que en años atrás, del 60 al 80 por ciento de los reportes eran de la industria, porque estaban obligados a hacerlos, “y la industria está sesgada, sesgada porque ellos producen, quieren vender y es legal. Es legal que quieran vender, pero no es legítimo que estén sesgados”.
Luis Adrián Quiroz, coordinador general de la asociación civil Derechohabientes Viviendo con VIH del IMSS (DVVIMSS), opina sobre la seguridad y calidad de los medicamentos:
“Yo diría que hay mala manufactura en la calidad y pongo un ejemplo, yo siempre cuestionaba por qué algunas pastillas te las llevas a la boca y antes que lleguen a la boca literalmente se hacen polvo, si eso es manufactura, entonces algo está fallando”. Y, sobre los procesos de farmacovigilancia, “sabemos que existen áreas dentro de la Cofepris, digamos, responsables a cargo de la farmacovigilancia. Hemos pasado por tres sistemas de notificaciones de reacciones adversas. ¿Pero, usted sabe qué es lo que sucede con la información que se recibe?”.
¿De qué nos alerta la industria farmacéutica?
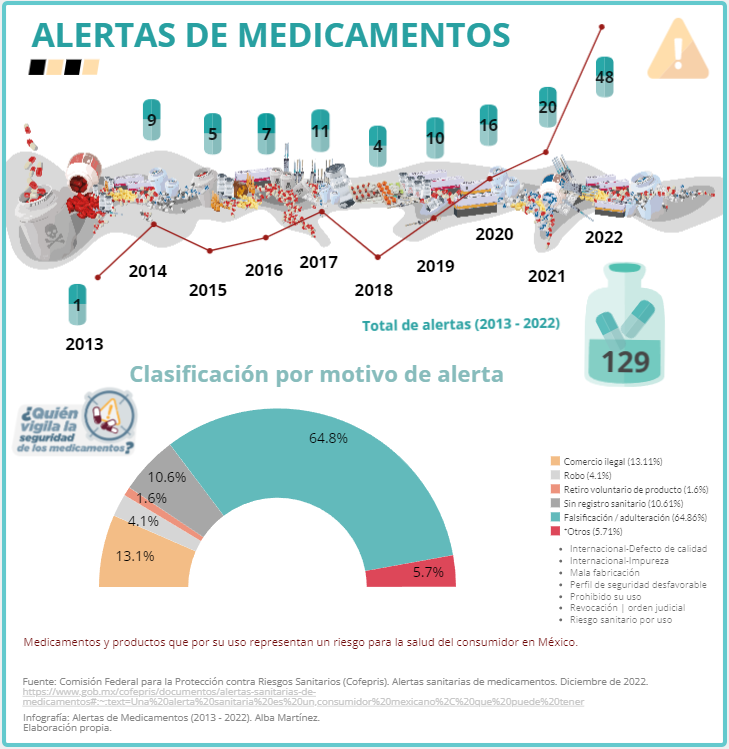
A diciembre de 2022, son 129 las alertas sanitarias comunicadas por la Cofepris hacia la población, la mayoría se emitieron por problemas de manufactura como envasado, etiquetado o por conocimiento de productos robados o falsificados, pero no por procedimientos de farmacovigilancia que hayan derivado en acciones de retiro de medicamentos del mercado.
Desde 2013 las alertas sanitarias muestran el interés de las empresas y laboratorios farmacéuticos por advertir a la población sobre el robo y falsificación de los medicamentos que pueden provocar daños a la salud de los consumidores y porque les perjudica en lo económico. Sin embargo, de la mala calidad, la inseguridad o la ineficacia, se desconoce.
Rafael Gual Cosío, director general de la Cámara Nacional de la Industria Farmacéutica (CANIFARMA), advierte que los medicamentos falsificados provocan perjuicio en el mercado, y son las Alertas Sanitarias las que constatan y comunican los posibles daños a la salud por el consumo de estos productos.
La afectación también es para la industria, conforme a los datos compartidos por el directivo de CANIFARMA, dice que en México esto representa un impacto del seis por ciento.
“En México está bastante constreñido. En algunos países se tienen índices del 35 a 40 por ciento de medicamento falsificado, claro que se complica también con el robo de medicamentos y demás”.
Son las empresas farmacéuticas y laboratorios los que, en su mayoría, informan y solicitan la emisión de las alertas sanitarias en su mayoría por robo y falsificación, pero no así alertan sobre los riesgos de mala calidad. Todos estos, asuntos de interés para la población del país.
Gual Cosío, asegura que la industria farmacéutica tiene los más altos estándares de fabricación, calidad y vigilancia y que el mayor inconveniente que padece aún la industria es el rezago de trámites ante la Cofepris. Explica que la industria farmacéutica es la principal proveedora de información para la farmacovigilancia del país.
“Tiene estándares incluso superiores a los que exige la ley y la reglamentación. Obviamente, Cofepris está encargada de dar los registros sanitarios, de vigilar que la información que se presente es adecuada, de hacer las visitas de verificación, en fin. El papel de Cofepris es muy importante en estos aspectos que menciono. Es mucho más estricta la autorregulación de la industria que la propia Cofepris”.
Juan de Villafranca, presidente ejecutivo de la Asociación Mexicana de Laboratorios Farmacéuticos (AMELAF) reconoce que años atrás la farmacovigilancia estuvo en manos de los terceros autorizados, empresas privadas que se hicieron cargo de actividades que correspondían a la Cofepris, pero que actualmente esto se está desalentando.
Evalúa que el mayor problema que enfrenta la Cofepris es el rezago y
“una ineficiencia, y ha faltado mucho de sistematización. Habían anunciado al principio de la administración que se iba a sistematizar todo. Han tenido también recortes presupuestales. No han reemplazado muchas plazas que han perdido. Entonces, ha sido un problema de administración. Hay un problema también de desconfianza”. Por otra parte, sobre la calidad y seguridad de los medicamentos importados que actualmente el gobierno mexicano compra, el directivo de la asociación dice que “se favorece la importación de medicamentos, pero nos ponen en una situación de desventaja desde el punto de vista competitivo. Lo más importante es cuidar que los medicamentos que vengan sean de calidad y que cumplan con las normas”.
¿Existen soluciones?
Especialistas señalan que las principales deficiencias de la farmacovigilancia se deben a la falta de transparencia y profesionalización de las partes involucradas en contraste con las regulaciones que se dan en países norteamericanos y europeos. Afirman que la participación ciudadana, de organizaciones civiles y hasta de los mismos consumidores, es vital para tener medicamentos seguros y con calidad.
“La invitación es que la población en general, los médicos, las enfermeras, que los investigadores hagamos ese reporte para que se tomen medidas y se identifiquen cuáles son los medicamentos que son seguros para nuestra población y cuáles son los que no son seguros y que se retiren si hay ineficacia terapéutica o intoxicaciones en pacientes”, afirma la investigadora Ernestina Hernández.
Sobre la retroalimentación en el flujo de información de las notificaciones de reacciones adversas, parte del proceso que se intenta solventar en el marco regulatorio, el investigador Rogelio Fernández Argüelles refiere que ésta es urgente para que se puedan tomar las medidas de seguridad que se requieren y así evitar daños severos a la población.
“La retroalimentación es urgente, si hay ese tipo de reacciones graves hay que reportarlas de manera prácticamente inmediata y hay que, inmediatamente, valga la redundancia, identificar si hay un lote, retener el lote y lo más que se pueda la propagación de ese medicamento, comercialización y no se den otras muertes”.
También afirma que gran parte de la solución al asunto es la profesionalización de la farmacovigilancia, ya que esta es una actividad sanitaria que bien puede ser una disciplina. “Lo que pasa es que ahí hay otro problema. En México tenemos la cadena del medicamento y está muy desprofesionalizada. No tenemos personal competente académicamente en las farmacias, eso en otros países, en Europa, cualquier farmacia pequeñita tiene un farmacéutico”.
Con lo anterior coincide el investigador Gilberto Castañeda-Hernández, “por eso necesitamos la farmacovigilancia con rectoría del Estado, pero también la farmacovigilancia académica, es decir, que haya investigación”.
De acuerdo con el investigador, en México la Cofepris no tiene los suficientes recursos humanos ni recursos materiales para poder realizar las actividades indispensables de farmacovigilancia:
“el problema más grave es que no tenemos programas de estudio, entonces estamos improvisando farmacovigilantes, no tenemos todavía maestrías y doctorados en farmacovigilancia como es el caso de muchos otros países”.
Castañeda también señala que debe garantizarse la transparencia en todos los procesos de farmacovigilancia y la salida al mercado de cada uno de los medicamentos, tanto los procesos de autorización, comercialización y farmacovigilancia. “La información no debe ser clasificada”.
De Canadá, por ejemplo, en internet se puede consultar todo lo que se llevó a cabo para la aprobación de cada medicamento. Se comparte responsabilidad con las empresas farmacéuticas y los órganos reguladores de gobierno. Se decide en función de la relación beneficio y riesgo. Si el beneficio es superior al riesgo se autoriza, pero si el riesgo es significativo no se autoriza.
“Tenemos una deuda muy importante con nuestra población y es una deuda por parte de la industria, de la autoridad sanitaria y de las instituciones académicas, o sea, los tres hemos hecho pues muchas faltas de omisión fundamentalmente”.
Recordemos, el sistema de notificación de reacciones adversas constituye la base de la farmacovigilancia mediante la cual se pueden detectar, evaluar, comprender y prevenir los riesgos asociados a los medicamentos y vacunas. Así, la farmacovigilancia debe garantizar el análisis del riesgo -beneficio, la seguridad del medicamento que empieza y termina con el paciente.
********
- Para fines de esta investigación, se solicitó entrevista directa con Farmacéutica Pisa, pero el área de relaciones públicas de la empresa comunicó que declinan la solicitud y se abstienen de hacer comentarios con respecto al tema.
- El subsecretario de Prevención y Promoción para la Salud, Hugo López-Gatell, también negó la posibilidad de entrevista, según expresó el área de enlace en el oficio SSPS-9610-222.
- De las solicitudes realizadas vía correo electrónico y de manera telefónica, aún se espera respuesta el actual titular de la Cofepris, Alejandro Svarch Pérez.
- El director de Farmacopea y Farmacovigilancia de la Cofepris, Felipe Ángel de la Sancha Mondragón, in situ, se negó a realizar la entrevista acordada.
********
Esta investigación se realizó como parte de la Maestría en Periodismo Digital de la Universidad de Guadalajara (UDG).
Link al sitio creado en torno a este programa académico: http://seguridadmedicamentos.worpress.org







